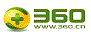厌氧生物处理技术因具有高有机负荷、低能耗及产能等优点而被逐渐广泛地应用到各类高浓度有机废水的治理中.然而,废水的来源各异,且含有多种对厌氧微生物有害的成分,其中,亚硝氮、硝氮、氨氮是厌氧处理过程中可能遇到的难题之一.亚硝氮、硝氮和氨氮进入厌氧段可能存在很多情况,如基于短程反硝化的厌氧产甲烷同时反硝化的提出和污水处理系统中好氧池污水回流脱氮等情况均会带来亚硝酸盐;果胶加工、炸药与金属制造及肥料应用的废水处理,以及厌氧产甲烷同时反硝化工艺的提出等都有可能带来一定浓度的硝酸盐;一些畜禽废物或食品加工废水的处理,以及含有较多如尿素和蛋白质等氨氮成分的废水处理等均会导致氨氮含量过高.
目前,针对这3种含氮无机化合物(亚硝氮、硝氮和氨氮)对厌氧微生物活性影响的研究多集中于对产甲烷活性和产甲烷菌的影响分析,而对厌氧细菌群落的急性影响研究还相对较少,仅有的研究也多偏向于氨氮部分,且缺乏这3种含氮无机化合物对厌氧细菌群落抑制作用的对比研究.复杂有机物的厌氧消化过程由一系列不同的微生物共同进行,主要包括发酵细菌,同型产乙酸细菌、产氢产乙酸菌及产甲烷菌.在厌氧群落中各类微生物之间协调互动,任何一类微生物受到抑制都将对整个系统造成影响.据对厌氧塘细菌和古生菌群落的定量PCR分析显示,厌氧 微生物中细菌的数量超过古生菌数量3个数量级以上,厌氧细菌群落在厌氧微生物群落结构中占很大比重,因此,研究这3种含氮无机化合物对厌氧细菌群落的影响具有重要意义.
磷脂脂肪酸(PLFA)法可以通过磷脂脂肪酸图谱对微生物群落进行快速有效的定量分析,且具备样品易保存、脂肪酸成分不易受影响、实验条件要求低、操作简便等优点.PLFA为甲基化活性污泥中提取磷脂后得到的脂肪酸产物,具有属的特异性,某一类PLFA总会出现在同一类群微生物中,且仅存在于活体细胞中.脂肪酸通常的命名格式为X:Y wZ(c/t),其中,X为总碳数,Y表示双键数,w表示甲基末端,Z是距离甲基的距离,c表示顺式,t表示反式,其他字符如a和i分别表示支链的反异构和异构,10Me表示一个甲基团在距分子末端第10个碳原子上,环丙烷脂肪酸用cy表示.微生物细菌种群结构可以通过微生物各类群的特征脂肪酸的相对含量表示,磷脂脂肪酸生物标记可反映厌氧细菌、革兰氏阳性菌、革兰氏阴性菌、放线菌和真菌等的相对含量.据相关报道可知,厌氧微生物群落中厌氧细菌优势种群多为革兰氏阳性、革兰氏阴性.多种支链脂肪酸可以表征革兰氏阳性菌,单不饱和脂肪酸和环丙烷脂肪酸可以用来指示革兰氏阴性菌,一些特定的磷脂脂肪酸(如18:1 w7c、15:0 a、15:0 i、16:0 i、17:0 i、19:0 cy等)则可用于表征厌氧细菌.因此,本文利用微生物磷脂脂肪酸(PLFA)的变化表征细菌微生物群落结构,以期为抑制物质对厌氧微生物活性及细菌群落的急性影响作进一步的解释,并为含这3种无机氮化合物的工业废水的厌氧处理提供理论依据.
2 材料与方法
2.1 厌氧颗粒污泥
厌氧颗粒污泥取自某制药集团的工业UASB反应器.污泥呈黑色,粒径为1.0~2.5 mm,湿污泥VSS/SS值为0.83.污泥经淘洗后,加入葡萄糖人工配水在中温(35 ℃)下进行间歇培养,经1个月驯化稳定后进行实验.
2.2 人工配水和无机氮化合物贮备液
人工配水(mg · L-1):葡萄糖2500,NH4Cl 280,NaHCO3 5000,K2HPO4 250,CaCl2 · 2H2O 10,MgCl2 · 6H2O 100,MgSO4 · 7H2O 100,酵母膏100,微量元素浓缩液(1 mL.
NaNO2(40 g · L-1,以N计)、NaNO3(40 g · L-1,以N计)和NH4Cl(50 g · L-1,以N计)贮备液由NaNO2(分析纯)、NaNO3(分析纯)和NH4Cl(分析纯)分别溶解于去离子水配制.
2.3 实验方法
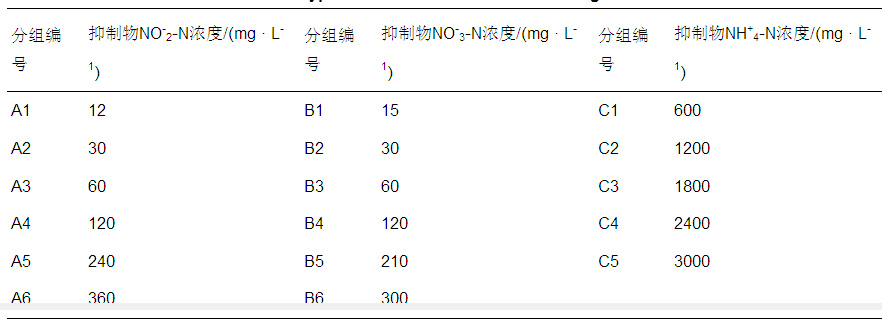
在100 mL血清瓶中加入60 mL配水,pH稳定在7.3±0.3,分别向3组血清瓶中加入一定量的NaNO2、NaNO3和NH4Cl贮备液,具体抑制物质及浓度情况见表 1.加入40 mL厌氧颗粒污泥,使用高纯氮气吹脱约5 min去除血清瓶中的溶解氧,密封后置于35 ℃恒温水浴振荡器中进行培养,每个浓度梯度设3个平行.
表1 抑制物质及浓度情况
 根据空白组COD去除率达到90%的时间(5 d)以确定取样时间.取出不同组的上清液样品对其COD进行测定,取出颗粒污泥并选择部分污泥样品进行扫描电镜分析和磷脂脂肪酸测定.
根据空白组COD去除率达到90%的时间(5 d)以确定取样时间.取出不同组的上清液样品对其COD进行测定,取出颗粒污泥并选择部分污泥样品进行扫描电镜分析和磷脂脂肪酸测定.
2.4 分析项目和方法
磷脂脂肪酸(PLFA)测定:PLFA提取方法根据牛川等方法进行并做适当修改,PLFA生物标记优势菌种分类方法根据牛川等方法进行,数据采用Excel和SPSS进行统计分析.
PLFA具体提取方法如下:①提取与分离:取5 mL厌氧污泥离心去上清液,加入15 mL提取液(甲醇 ∶ 氯仿 ∶ 磷酸缓冲液=2 ∶ 1 ∶ 0.8,体积比),涡旋振荡1 min,室温下往复式振荡16 h,静置10 min,收集上清液;再加15 mL提取液涡旋振荡1 min,室温下往复式振荡2 h,静置10 min,收集上清液;合并上清液,加入2.5 mL氯仿和2.5 mL无菌水,振荡1 min,取下层液体在40 ℃电热干浴用氮气吹干,然后用1 mL氯仿溶出;氯仿提取样品用硅酸柱洗脱,在5 mL甲醇洗脱液中加入50 mg · L-1内标十九烷酸100 μL,在40 ℃电热干浴用氮气吹干,后用1 mL氯仿溶出;②皂化:加入1 mL试剂1(NaOH ∶ 甲醇 ∶ 蒸馏水=45 g ∶ 150 mL ∶ 150 mL),拧紧盖子振荡5~10 s后,置沸水浴5 min,振荡5~10 s后再放置于沸水浴中25 min,取出后用冰浴冷却;③甲基化:加入2 mL试剂2(6 mol · L-1 HCl ∶ 甲醇=325 mL ∶ 275 mL),涡旋振荡,80 ℃加热保温10 min,取出后冰浴冷却;④萃取:加入1.25 mL试剂3(正己烷 ∶ 甲基叔丁醚=200 mL ∶ 200 mL),振荡提取PLFA甲酯,吸取上层正己烷相;⑤洗涤:加3 mL 1.2%的NaOH溶液,摇动5 min,吸取上层溶液转入气相色谱瓶.
PLFA采用安捷伦7890A气相色谱测定,气相色谱各参数由MIDI Sherlock程序设置调用.扫描电镜分析:污泥样品预处理方法根据方法进行.CODCr等按照《水和废水监测分析方法》测定.
3 结果
3.1 不同抑制物质及浓度下COD去除率情况
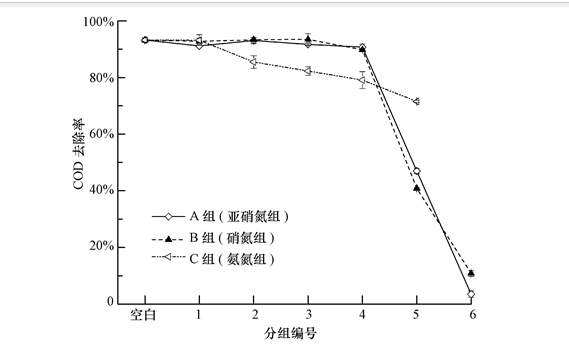
不同NO-2-N、NO-3-N和NH+4-N浓度条件下COD的去除率情况如图 1所示,进水COD值均为(1958±4.64)mg · L-1,空白组的COD去除率为93.23%.由于抑制作用,3种抑制物质作用下的COD去除率均随抑制物浓度升高呈下降趋势,A组(亚硝氮组)和B组(硝氮组)的抑制趋势较为接近,C组(氨氮组)与前两组有明显区别.A组中,低浓度的亚硝氮并未对COD去除率造成严重影响,40 mg · L-1亚硝氮使COD去除率降低至46.97%,亚硝氮浓度高达360 mg · L-1时COD去除率降至最低即3.49%;B组中,低浓度硝氮(15、30、60、120 mg · L-1)对COD去除率的抑制作用不明显,210 mg · L-1硝氮使COD去除率下降至40.86%,硝氮浓度高达300 mg · L-1时COD去除率下降至10.85%;C组中,随着氨氮浓度的升高,COD去除率呈坡度下降趋势,但下降趋势并不急剧,浓度最高达3000 mg · L-1时COD去除率仅下降至71.53%.
图1 不同浓度NO-2-N、NO-3-N和NH+4-N条件下COD的去除率情况(横坐标各组对应的具体浓度值见表 1)
研究发现,硝氮对颗粒污泥抑制作用50 h后,随着硝氮浓度从75 mg · L-1增加到300 mg · L-1,颗粒污泥对COD的降解速率从402.72 mg · h-1 · g-1降至171.59 mg · h-1 · g-1,而低浓度硝氮条件下厌氧颗粒污泥的COD去除效果无明显变化,表明颗粒污泥在低浓度的硝氮负荷下具有一定的抵御能力,与本实验结论相近,这可能是由于低浓度下抑制物在颗粒污泥中迁移传质受到限制.虽然低浓度硝氮和亚硝氮作用颗粒污泥5 d后COD去除率未明显下降,但在测定厌氧微生物活菌百分比时发现,颗粒污泥中厌氧微生物的活菌百分比发生下降(如60 mg · L-1的亚硝氮和硝氮分别使厌氧微生物的活菌百分比降低至68.8%和74.9%).通过对系统中氨氮浓度的测定发现,C组中的氨氮在系统中的浓度随时间几乎没有明显变化,这可能是由于在厌氧污泥体系中能够利用氨氮的微生物较少,抑制是一直存在的,因此,氨氮组即使在较低浓度也会出现COD下降现象.
3.2 颗粒污泥表观形态变化
根据3.1节中的COD去除率变化选择具有代表性的浓度组(A组:A2、A4、A6;B组:B2、B4、B6;C组:C1、C3、C5)进行各项指标的测定.图 2为放大10000倍后的颗粒污泥的扫描电镜图.由图 2可见,空白组厌氧颗粒污泥表面几乎为8~25 μm长的杆状菌,伴随有少量的球菌,污泥表面凹凸不平孔隙交错,是内部微生物能量代谢的重要通道.在高浓度的亚硝氮、硝氮和氨氮(A6、B6和C5)作用下,厌氧颗粒污泥的表面结构都发生明显变化,污泥表面的主要细菌由杆状菌变为球状菌,几乎不见杆菌.低浓度抑制作用下,污泥表面主要细菌为杆菌和球状菌,且与空白组相比杆菌比例明显降低.
图2 不同条件下厌氧颗粒污泥扫描电镜图(×10000)
3.3 PLFA生物标记及脂肪酸分类分析
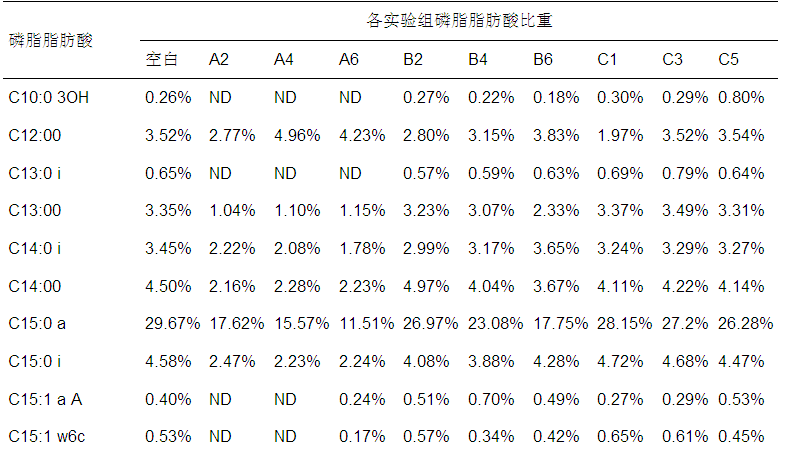
各组样品的PLFA组成情况如表 2所示,其中,在各组样品中含量比均低于0.5%的PLFA因含量过低而不具体列出,磷脂脂肪酸的碳链长度主要分布在C10~C20之间,共检测到31种类型的磷脂脂肪酸,其中,占主要比重的磷脂脂肪酸为C15:0 a和C16:00.表 2中,与空白相比,A组和B组中的C15:0 a含量随着抑制物质浓度的升高呈现下降趋势,而C15:0 a在指示厌氧细菌和革兰氏阳性菌的PLFA中占有较高负荷.C组的C17:1 w8c与空白相比随着抑制物质浓度升高呈现下降趋势,且C17:1 w8c为指示革兰氏阴性菌的PLFA的主要因子.
表2 厌氧颗粒污泥整体磷脂脂肪酸情况
本实验基于表 2数据的统计分析,通过PLFA生物标记优势菌种研究了这3种抑制物质对厌氧细菌群落的影响,各样品中PLFA生物标记优势菌种变化如图 3所示.由图 3可知,所有样品的优势菌种均为革兰氏阳性菌和厌氧细菌.在亚硝氮、硝氮和氨氮存在下,微生物细菌群落结构均发生了变化;亚硝氮和硝氮对生物标记优势菌种的影响呈现一定的相似性,氨氮的抑制效果区别于前两者.A组中,随着亚硝氮浓度的上升,厌氧细菌和革兰氏阳性菌的百分比呈现下降趋势,高浓度亚硝氮(360 mg · L-1)使厌氧细菌含量由37.71%下降至16.09%,革兰氏阳性菌含量由44.04%下降至19.73%,革兰氏阴性菌呈现出先下降后略微上升的趋势.目前,有关亚硝氮和硝氮对厌氧细菌群落结构的影响还鲜见报道,多偏向于对生物除磷系统微生物群落的影响研究.如研究了亚硝氮对强化生物除磷系统的影响,结果表明,亚硝氮的存在改变了微生物群落结构且群落组成无法恢复,聚糖菌(GAOs)相比聚磷菌(PAOs)具有更强的抵抗力和恢复能力.B组中,随着硝氮浓度的上升,厌氧细菌和革兰氏阳性菌同样呈现下降趋势,高浓度硝氮(300 mg · L-1)使厌氧细菌含量下降至26.32%,革兰氏阳性菌含量下降至23.85%,而革兰氏阴性菌无明显变化规律.C组中,随着氨氮浓度的上升,厌氧细菌和革兰氏阳性菌基本无明显变化,革兰氏阴性菌具有一定的下降趋势,高浓度氨氮(3000 mg · L-1)使革兰氏阴性菌含量由14.72%下降至10.51%.Calli等研究了450 d内6000 mg · L-1氨氮对厌氧微生物的影响,结果表明,产乙酸菌比产甲烷菌对氨氮的敏感性更高,而产乙酸菌如Clostridium aceticum、Acetobacterium woodii等多为革兰氏阳性菌.在研究氨氮对高温厌氧微生物的影响时发现,抑制时间为120 d时细菌优势菌种Firmicutes含量由原来的84.3%升高为94.7%,Actinobacteria含量由原来的7%下降为2.3%,而Firmicutes和Actinobacteria均为革兰氏阴性菌.由此可见,氨氮虽对PLFA生物标记厌氧细菌和革兰氏阳性菌的总量没有明显影响,但可能对其中不同种类微生物所占比重有影响.
图3 PLFA生物标记优势菌种
3.4 主成分分析
主成分分析(PCA)可以通过不同样品PLFA的状况反映微生物种群的变化.主成分1(PC1)和主成分2(PC2)分别含有62.71%和18.64%的差异度(图 4).因子C15:0 i、C18:00、C13:00、C15:0 a、C16:00、C14:0 i、C16:0 i和C14:00在PC1上有较高的负荷,因子C17:00、C19:00、C18:1 w7c 11-methyl、C17:0 2OH、C17:0 i 3OH和C17:0 a在PC2上有较高的负荷.
由图 4可以看出,PC1反映了不同抑制物质对PLFA的影响,PC2反映了不同抑制浓度对PLFA的影响.主成分分析显示,各样品间有较明显的差异,A2、A4、A6、B6与空白之间的差异度较大,剩余样品与空白之间的差异度相对较小.厌氧微生物的PLFA对亚硝氮的敏感度最高,即使低浓度的亚硝氮(A2)也会引起PLFA较大的变化;与亚硝氮不同,高浓度硝氮(B6)会引起PLFA较大变化,而低浓度(B2和B4)下与空白的差异度较小;氨氮(C1、C3和C5)对厌氧微生物PLFA的影响相对前两者较小,且在浓度梯度上变化不大.
3.5 PLFA香农-威尔(Shannon-Wiener)多样性分析
本文运用Shannon-Winener多样性指数考察PLFA的丰富度和均匀度,来反映微生物种群的多样性.Shannon-Winener多样性指数通常被定义为:
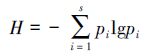
其中,H为Shannon-Winener指数,s为样品中磷脂脂肪酸的总数,pi为各磷脂脂肪酸所占百分比(Niu et al., 2012).
各样品的Shannon-Winener多样性指数见表 3.由表 3可知,与空白相比,亚硝氮导致微生物细菌种群多样性下降,30 mg · L-1亚硝氮即可使PLFA多样性指数下降至1.02,亚硝氮的浓度越高,微生物的PLFA多样性指数越低;高浓度硝氮(如B4和B6)会导致PLFA多样性下降,而低浓度硝氮(如B2)对PLFA多样性指数并无明显影响;氨氮组中,随着氨氮浓度的升高,PLFA多样性指数并无降低现象.
表3 各个样品香农-威尔多样性指数
亚硝氮和硝氮导致厌氧微生物PLFA多样性指数下降,一方面可能归因于反硝化功能菌群在污泥体系中的地位得以增强,另一方面可能是由于亚硝氮和硝氮对某些微生物具有直接的毒性作用,从而导致这部分微生物直接死亡.而氨氮的毒性作用并没有影响微生物细菌群落的多样性,这与Zhang等的研究结论相一致.
4 结论
1)亚硝氮和硝氮浓度低于120 mg · L-1时系统COD去除率无明显变化,当二者浓度高于120 mg · L-1后随浓度增加抑制作用增强;氨氮对COD去除率的抑制程度随浓度的升高而增加.
2)高浓度的亚硝氮、硝氮和氨氮作用下,污泥表面的主要细菌由杆状菌变为球状菌;低浓度下,污泥表面杆菌和球状菌并存.
3)无论是从COD变化角度还是从PLFA生物标记优势菌种角度看,亚硝氮和硝氮均呈现相似的抑制模式,氨氮与前两者有显著差异.亚硝氮和硝氮使厌氧细菌和革兰氏阳性菌的含量下降,而氨氮仅作用于革兰氏阴性菌;亚硝氮和硝氮对PLFA香农-威尔多样性指数有明显影响,而氨氮并无明显作用.
如需要产品及技术服务,请拨打服务热线:13659219533
选择陕西博泰达水处理科技有限公司,你永远值得信赖的产品!
了解更多,请点击www.botaida.com