海洋细菌是海洋生态系统中的重要组成部分,在海洋物质循环、能量流动以及生态调控等方面具有重要作用.海洋细菌的群落结构与种类组成直接影响整个海洋生态系统的健康发展,同时细菌群落结构又与其栖息的环境密切相关.海洋细菌的分类鉴定及其群落结构的分析方法包括表型鉴定法和分子遗传学鉴定法两大类(金光,2011),表型鉴定法包括细菌形态和生理生化水平、细胞组分水平、蛋白质水平上的鉴定,分子遗传学鉴定法是在核酸水平上的鉴定,包括核酸杂交、PCR 技术、16S rRNA序列分析、全基因组测序等.
变性梯度凝胶电泳(Denaturing gradient gel electrophoresis,DGGE)技术最早是由Fischer和Lerman于1983年创立的,是根据在不同浓度的变性剂中DNA片段解链行为的不同而导致电泳迁移率发生变化,从而将片段大小相同而碱基组成不同的片段分开.近年来PCR-DGGE技术已经广泛运用于细菌的群落结构分析中.
大亚湾位于南海北部,是广东省重要的养殖基地,也是大亚湾核电站和惠州港所在地.由于近些年该海域污染日趋严重,海洋环境状况发生显著变化,浮游细菌群落结构也会发生明显变化.目前有关大亚湾浮游细菌方面的报道不多,尚未有浮游细菌DNA指纹及分子多样性方面的报道.为了了解大亚湾海域浮游细菌群落结构以及分子多样性,本文采集了大亚湾海域表层水样,利用PCR-DGGE技术对浮游细菌的DNA指纹进行了研究,以揭示DGGE技术等分子手段在浮游细菌群落结构多样性分析上的应用.
2 材料与方法
2.1 样品的采集与处理
在广东省大亚湾海域设置的9个采样点(图 1).S1~S3位于大亚湾澳头海域,该海域毗邻惠州市澳头镇,是重要网箱鱼类养殖基地;S4~S6位于大鹏澳海域,该海域位于深圳市大鹏镇,湾内有鱼类和贝类养殖区,同时也是大亚湾核电站和岭澳核电站所在地;S7~S8位于大亚湾湾口,受到养殖和人类活动的影响较小.分别于2010年12月15日(2010年冬)、2011年6月8日(2011年夏)采集表层水样,每个采样点采集水样9 L,并在现场用中性鲁哥试剂固定.固定的水样先用孔径为10 μm网筛过滤,然后再依次用GF/A滤膜(Whatman)以及 0.2 μm 聚醚砜滤膜(Millipore)过滤,滤膜上的样品置于1.8 mL SET裂解缓冲液(20% 蔗糖,50 mmol · L-1 Tris-HCl pH 7.6,50 mmol · L-1 EDTA)中,储存在-20 ℃待分析.

图1 大亚湾采样点的设置
2.2 水环境因子的测定
水温、盐度、电导率、溶解氧(DO)、pH值等理化因子通过采用美国YSI-561多参数水质分析仪进行现场测定,透明度用萨氏盘测定.
2.3 DNA的提取及16S rRNA基因V3区的PCR扩增
利用美国Omega公司细菌基因组DNA的提取试剂盒提取细菌基因组DNA,方法参照产品说明书.采用原核生物通用引物Eubac341F(5′-CCT ACG GGA GGC AGC AG-3′)和Eubac517R(5′- ATT ACC GCG GCT GCT GG-3′)对细菌rRNA基因16S V3区的保守序列进行PCR扩增(Muyzer et al., 1993; Celussi et al., 2008),并在Eubac341F 5′端添加GC2夹子:5′- CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG GCC-3′),扩增体系为30 μL,扩增体系中各组分含量为别为:10×buffer 3 μL,dNTP 1 μL,上下游引物各0.3 μL,Taq DNA聚合酶0.4 μL,DNA模板1 μL,ddH2O 21 μL.PCR扩增反应程序:95 ℃ 4 min,94 ℃ 30 s,65~55 ℃ 30 s,72 ℃ 25 s每个循环降0.5 ℃,(94 ℃ 30 s,55 ℃ 30 s,72 ℃ 25 s)× 20个循环,72 ℃ 7min,4 ℃ ∞.扩增产物用1%琼脂糖凝胶进行检测,用1×的gelgreen工作液进行胶前染色.
2.4 DGGE分析
取PCR产物30 μL,在Bio-Rad公司的DcodeTM通用突变检测系统对PCR产物进行DGGE分析,DGGE条件为:丙烯酰胺质量分数 8%,变性梯度40%~64%(100%的变性剂浓度为7 mol · L-1尿素和质量分数40%去离子甲酰胺),并在上述两种凝胶液中分别加入100 μL 10%的过硫酸铵(ASP)和10 μL的四甲基乙二胺(TEMED).先用200 V预电泳20 min左右以去除胶空中的杂质,然后加入PCR产物样品,200 V电泳5 h.200 V电压电泳20 min,然后再用 200 V电压电泳5 h,缓冲液为1 × TAE,电泳结束后用超纯水冲洗两次,后置于1×SybrGreen工作液中避光染色30 min,用 Bio-Rad公司凝胶成像系统(GelDoc2000TM)进行拍照,DNA指纹图谱用Quantity one软件进行分析.
2.5 数据分析与处理
2.5.1 Shannon-Weaver多样性指数(H′)
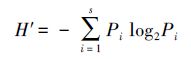
式中,n为每个泳道的条带数目,Pi=Ni/N,Ni为第i条条带的峰面积,N为该泳道所有条带的峰面积总和.
2.5.2 Pielou均匀度指数(J)
其中,H′为某泳道的Shannon-Weaver多样性指数,S为对应泳道的DNA指纹条带数.
2.5.3 统计分析
利用SPSS 18.0对冬季和夏季浮游细菌DNA指纹条带数、H′和J值进行显著性差异t检验,对DNA指纹条带数与环境因子进行Pearson相关性分析.
3 结果
3.1 水环境因子
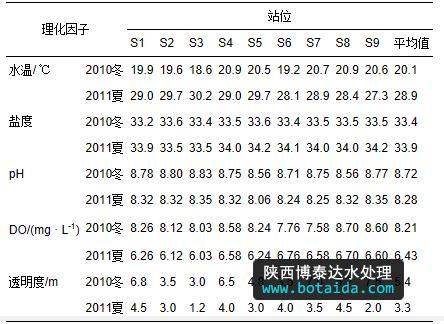
表 1列出了两次调查中大亚湾海域各站位的水环境因子,可以看出大亚湾海域水温较高,即使在12月份的冬季,水温仍可以达到20 ℃左右;夏季水温则高达29 ℃左右.各站位间水温差异不大,一般小于1 ℃.两次调查期间盐度相近,在33~34之间.冬季pH值略高于夏季,而DO值和透明度则明显高于夏季.
表1 2010年冬及2011年夏大亚湾海域水环境因子
3.2 DGGE指纹图谱分析
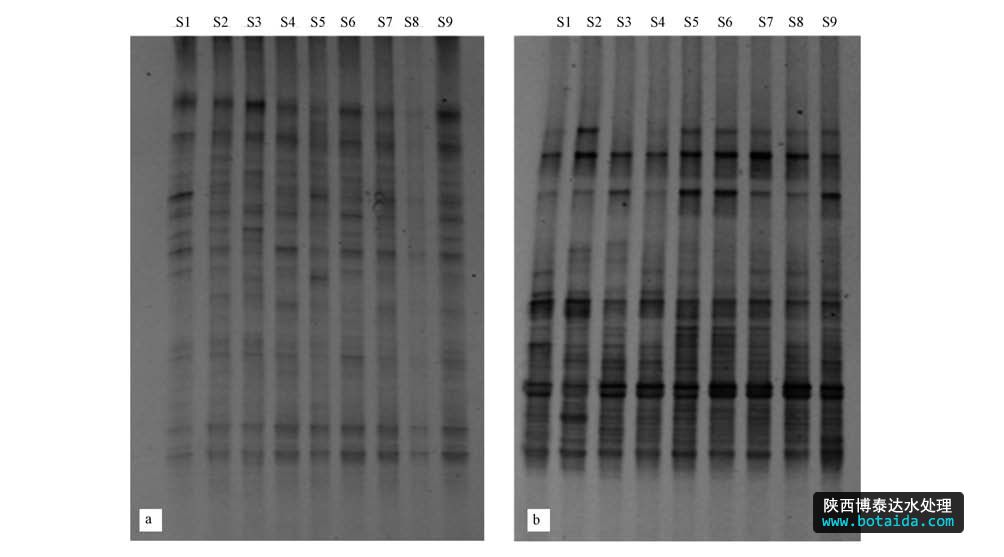
2010年冬季和2011年夏季大亚湾海域浮游细菌的DNA指纹图谱见图 2.结果显示,条带分离较好,冬季条带亮度较夏季弱,冬季浮游细菌丰度较低.从带型模拟图(图 3)中可以更清楚看到各站位浮游细菌DNA指纹图谱,冬季和夏季样品中分别共得到32条和33条条带.
图2 大亚湾海域浮游细菌16S rDNA V3区DNA图谱(a. 2010年冬,b. 2011年夏)
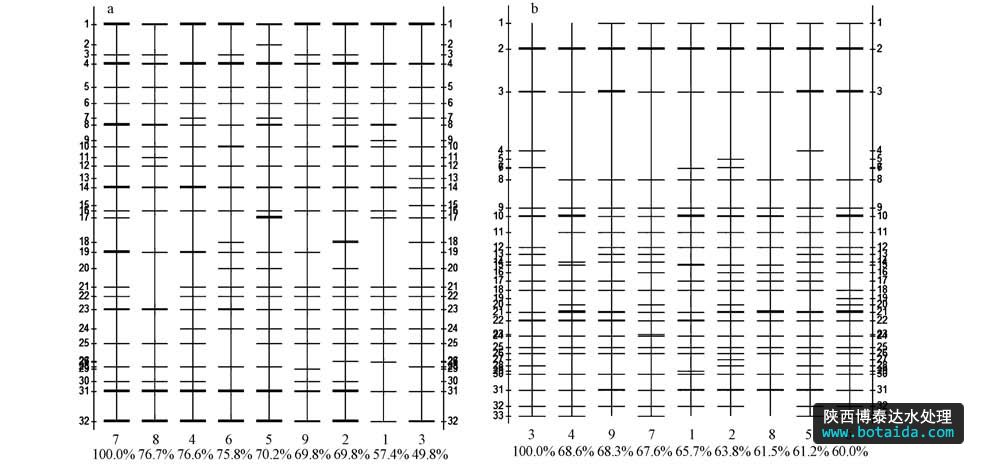
图3 大亚湾海域浮游细菌16S rDNA V3区DGGE图谱分析带型图(其中水平轴上的数字(1~9)为站点编号,百分比是与标准泳道的匹配度; 垂直轴上的数字为DNA条带编号(a. 2010年冬,b. 2011年夏))
冬季样品共有的优势条带较多,如灰度较大的优势菌群条带1、2、5、8、10、11、12在各个站位均有出现,条带1和条带2为最为常见优势条带,条带11和12在S2以及S5~S8站位较为丰富(图 3a).以S7为标准,其余站位与之匹配度为49.8%~76.7%之间,位于大鹏澳海域的几个站位与S7的匹配度较高,而位于澳头海域的S1~S3与之匹配度较低,说明这两个海域浮游细菌存在一定空间异质性,但整体来说比较均一.
夏季样品中共同的优势条带较少(图 3b),条带2在每个站点均出现,且灰度值比较大,为优势菌群;但有些灰度值较大的条带(优势菌群)只在部分采样点出现,如条带3、10、21、31.以S3为标准,所有泳道与S3的匹配度差别不大,在60.0%~68.6%之间(图 3b),说明夏季浮游细菌空间分布差异较低.
3.3 浮游细菌DNA指纹多样性
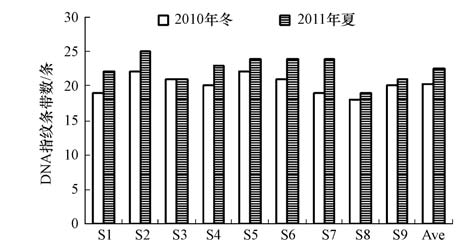
大亚湾海域浮游细菌DNA指纹条带数见图 4.各站位条带数变化不大,冬季为18~22条,平均为20条;夏季较高,为19~25条,平均为23条.夏季指纹条带数明显高于冬季(p<0.01).
图4 大亚湾浮游细菌DNA指纹条带数
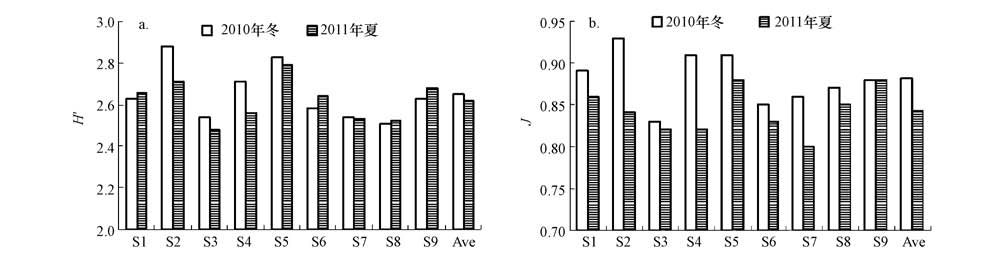
与DNA指纹条带数不同,冬季DNA指纹的Shannon-Weaver多样性指数(H′)略高于夏季(p>0.05),冬季和夏季H′值的变化范围分别为2.51~2.88和2.48~2.79;而均匀度(J)则在冬季明显较高(p<0.01),冬季和夏季分别为0.83~0.93以及0.80~0.88.
3.4 浮游细菌DNA指纹与环境因子的关系
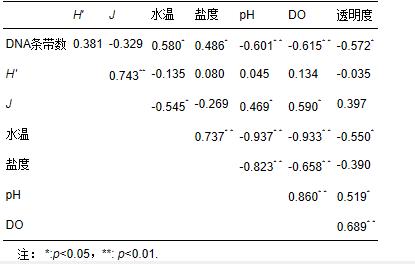
从浮游细菌与环境因子之间的相关关系可以看出,DNA指纹条带数与环境因子密切相关,其中与温度和盐度明显正相关(p<0.05),而与pH、DO以及透明度明显负相关(p<0.05或p<0.01),结果说明高温高盐可促进浮游细菌多样性,而pH、DO、透明度下降等水质恶化现象则可降低浮游细菌的种类丰富程度.H′值仅与J值呈明显正相关;而J则与水温明显负相关,与pH和DO明显正相关.各种环境因子之间几乎均呈现出明显的相关关系,其中水温与pH、DO、透明度均明显负相关(p<0.05或p<0.01),说明夏季水质较冬季差;而DO又与pH和透明度明显正相关(p<0.01).
图5 大亚湾浮游细菌DNA指纹的Shannon-Weaver多样性指数(H′)和PieLou均匀度(J)(a. H′,b. J)
表2 浮游细菌DNA指纹及其多样性指数与环境因子的相关关系
4 讨论
4.1 大亚湾海域浮游细菌多样性
浮游细菌种类丰富程度以及DNA指纹条带数与海域环境状况以及富营养化程度密切相关,在富营养化海区细菌丰度较高,但种类数和多样性下降.在本研究中,DNA指纹条带数与pH、DO以及透明度均呈明显的负相关关系,说明水质能影响浮游细菌的种类数.大亚湾海域浮游细菌种类较丰富,每个样品观察到的DNA条带数为18~25条,冬季和夏季分别检测到32和33条带.在同期的可培养浮游细菌调查中,共分离培养了70株菌株,根据16S rDNA序列分析,获得了35个不同序列,细菌种类数与本研究相近.大亚湾海域浮游细菌的DNA指纹条带数明显高于以往的研究报道,如黄海冷水团海域的浮游细菌DNA指纹条带数仅17条左右(刘敏等,2008),东海长江口赤潮高发区各站位浮游细菌指纹条带数不超过20条,葡萄牙的Ria de Aveiro海域浮游细菌的条带数与本研究相近,为17~24条;而与地中海西北部海域浮游细菌的DNA指纹条带数相近,为26~36条.
但是大亚湾海域浮游细菌的Shannon-Weaver多样性指数(H′)较低,平均仅为2.63,低于其他海域浮游细菌多样性指数,并且低于同期调查的本海域可培养浮游细菌的多样性指数.大亚湾海域DNA指纹条带较丰富,说明该海域物种数较丰富,但某些耐受能力较强的物种在数量上占据优势,致使细菌菌落结构多样性下降.从DNA指纹图谱和带型模拟图中也可看出,优势种类亮度较高,优势度明显.大亚湾海域曾被认为是我国近岸海域水质较好的港湾之一,但近年来富营养化程度明显上升,而且营养盐补充及时,初级生产力较高(孙翠慈等,2006).在近年来的浮游植物调查中,也发现大亚湾浮游植物种类丰富,数量较高,浮游植物种类多样性指数较低的现象.
虽然夏季浮游细菌的DNA指纹条带数明显高于冬季,但冬季的种类多样性指数和均匀度指数略高于夏季.一般在温带海域浮游细菌季节变化明显,冬季细菌种类多样性和数量均明显低于夏季.大亚湾位于亚热带,全年平均水温在25 ℃以上,冬季水温也较高,即使在12月份水温也达到20 ℃左右.因此,浮游细菌的生长不会受到冬季低温的影响,但浮游细菌DNA指纹条带数仍与水温呈明显的正相关关系,而H′则与水温负相关,结果说明高温能促进细菌种类数,但种类多样性下降.大亚湾海域浮游植物群落结构与浮游细菌相近,同样是夏秋季节浮游植物种类丰富,数量较高,但是多样性指数较低;冬季虽然种类数下降,数量也同时下降,各物种分布更加均匀,种类多样性上升.而浮游细菌群落结构变化主要由水体中营养物质引起以及有机质有关,大亚湾属于一个封闭性养殖内湾,有机物质含量丰富,而冬季浮游植物高峰也为浮游细菌提供了丰富的有机质.
4.2 DGGE技术在细菌群落结构研究中的应用
DGGE技术能在一定程度上较全面反映浮游细菌群落结构,不能培养的细菌特别是未能培养的优势菌群能在DGGE图谱中得到反映.如与本研究同时采集的大亚湾水样,用培养法一个样品最多能培养出12个菌株(江晓亮等,2013),而DGGE技术则能显示出18~25个条带.但是利用PCR-DGGE技术对细菌群落结构进行分析尚存在一些不足,在PCR-DGGE过程中,优势种对非优势种具有屏蔽作用,DNA样品中低于1%的种类无法在DGGE图谱中显现出来(Muyzer et al., 1993);而不同细菌之间基因的拷贝数以及基因组大小的差异性也会对细菌DNA指纹数及亮度产生影响,从而导致该技术对浮游细菌群落结构的评价产生偏差.
此外PCR-DGGE技术不能对细菌进行准确的分类鉴定,仅能相对反映细菌的种类多样性.如果需要对细菌进行进一步分类鉴定,需要切胶测序.而且PCR-DGGE技术不能准确对细菌进行定量分析,DGGE条带的强弱程度只能表示不同种类的细菌之间的相对丰度.虽然本研究未对DGGE条带进行切胶测序,但在同期调查中对可培养细菌进行了16s rDNA 序列测定(江晓亮等,2013),分析鉴定了35种可培养细菌,其中以α-变形菌纲(Alphaproteobacteria)和放线菌纲(Actinobacteria)为分离最多的两大类,此外还包括β-变形菌纲(Betaproteobacteria)、盖球菌属(Kytococcus)以及间胞囊菌属(Intrasporangium)的菌株.
由此可见,虽然PCR-DGGE技术在研究群落动态和多样性方面存在优势,但该技术无法给出细菌的代谢活性、数量和基因表达水平方面的信息,必须与其他技术相结合以弥补其本身的不足,如酶学分析均可以提供群落代谢活性特征,荧光原位杂交技术可以提供细菌的相对数量,而通过与荧光定量PCR结合,可以对群落的细菌数量进行定量分析.因此,PCR-DGGE技术与其他分类以及分子生物学技术结合后,可更好地反映海洋细菌群落结构与功能.
4 结论
1)大亚湾海域浮游细菌DNA指纹条带丰富,在2010年冬和2011年夏的调查中共分别得到32和33条DNA指纹条带,每个样品的DNA条带数为18~25条.
2)高温高盐可促进浮游细菌多样性,而pH、DO、透明度下降则可降低浮游细菌的种类丰富程度.
3)夏季DNA指纹条带数明显高于冬季,但冬季的多样性指数与均匀度指数较高.
如需要产品及技术服务,请拨打服务热线:13659219533
选择陕西博泰达水处理科技有限公司,你永远值得信赖的产品!
了解更多,请点击www.botaida.com