磷超标是造成水体富营养化的主要原因之一.研究发现,当总磷浓度超过0.1 mg · L-1(磷作为限制因素,mTN ∶ mTP>15 ∶ 1),藻类会过度繁殖;一般情况下,总磷浓度超过0.02 mg · L-1就有可能导致水体富营养化. 由于水体富营养化现象日趋严重,严重破坏了人类赖以生存的自然环境,威胁着人类的健康.常规的生化处理工艺效率低,不能从根本上解决问题.近些年,微生物除磷工艺的研究得到了迅速发展,主要有A/O、A2/O、UCT、五段Bardenpho、Phostrip等.为实现微生物除磷工艺的有效实施,筛选出除磷能力较强的聚磷微生物是首要目标.此外,考虑到聚磷微生物对磷的吸收是一个厌氧释磷、好氧吸磷的过程,有必要考察聚磷微生物对溶氧的响应. 同时,微生物聚磷过程会受有机质分子大小、pH等的影响. 因此,考察特定微生物在不同理化条件下的生长情况和除磷特性是实现微生物除磷机理研究及其在工程应用的前提条件.
为获得除磷能力较强的微生物种质资源,自聚磷菌首次被分离以来,至今已有多种具备聚磷能力的微生物被筛选出来.多项研究表明,产碱杆菌属细菌(Alcaligenes sp.)具备这方面的能力. 此外,肠杆菌(Enterobacteriaceae)、金黄色葡萄球菌(Staphyloccocus)Accumulibacter、变形菌(Alphaprotenbacteria)等也是常见的聚磷微生物,甚至存在兼具反硝化功能的聚磷微生物. 在此基础上,人们又开展了大量关于溶氧对聚磷菌除磷能力的影响研究,但这些研究较少涉及不同聚磷菌在不同的厌氧时间条件下对好氧吸磷的相关作用.此外,诸如pH和有机质分子大小等理化因素对聚磷菌聚磷能力的影响也已得到较深入研究. 然而,当前的多数研究只局限于对单一因素的考察,抑或集中于研究高浓度废水的生物处理系统,目前,聚磷微生物除磷工艺离工程应用仍有较大的距离.正如研究表明,微生物的固定化能够为其活性持留提供保障. 然而,考察固定化聚磷菌对含磷废水的修复实验尚未见相关报道. 因此,继续筛选和开发具备高效除磷功能的微生物,开展聚磷微生物的固定化、活性持留及污水修复并开展综合理化因素对聚磷微生物除磷能力的影响等方面的研究对工程实践有重要指导意义.
鉴于此,本研究从排污口淤泥中筛选出1株具备高效除磷能力的聚磷菌,全面考察各理化因素对菌株生长及除磷能力的影响. 同时,对微生物进行固定化,并重点考察其对含磷废水的净化效果.
2 材料与方法
2.1 材料
2.1.1 样品来源
淤泥样品采自福州市闽侯县上街镇高岐村某排污口,立即用于菌种的分离与筛选.
2.1.2 培养基
富集培养基、筛选培养基、微量元素,以及缺磷培养基和富磷培养基分别按文献进行配制.LB培养基(g · L-1):蛋白胨 10.00,酵母粉5.00,NaCl 10.00,琼脂2.00(固基加入),pH=7.2.固定化微生物小球实验培养基(g · L-1):丁二酸钠0.61,NaNO3 0.28,KH2PO4 0.1,KCl 0.014,MgSO4 · 7H2O 0.02,CaCl2 · 2H2O 0.018,pH =7.2.
以上所有培养基均经121 ℃灭菌(碳源实验中,葡萄糖和蔗糖组115 ℃灭菌)20 min后使用,微量元素于灭菌前加入.
2.1.3 微生物固定化小球制备材料
聚乙烯醇(Polyvinyl alcohol,PVA)、海藻酸盐(Sodium alginate,SA)、硼酸(H3BO3)、无水氯化钙(CaCl2),除硼酸(分析纯)外其余均为化学纯.
2.2 方法
2.2.1 聚磷菌的分离鉴定
称取0.5 g新鲜淤泥,用无菌水水洗后8000 r · min-1离心5 min,弃上清,此过程重复3次. 处理后将样品加入2.1.2节的富集培养基中,添加量及其他条件参考文献. 培养12 h后,取1.5 mL菌悬液于下一磷梯度的培养基中,磷梯度依次为2、5、8、10、15和20 mg · L-1(以P计).
聚磷菌含有典型的PHB颗粒和异染颗粒,经强化释磷、吸磷实验后,PHB颗粒可被脂溶性染料苏丹黑着色,异染颗粒可被甲苯胺蓝和次甲基蓝染成紫色,可与其他非颗粒性物质区分开来. 将富集驯化的菌悬液按10-1~10-7梯度进行稀释,涂布平板. 挑取形态较特殊的单菌落进行PHB颗粒染色和异染颗粒染色,确定含有PHB颗粒和异染颗粒的菌落,进行复筛实验.
挑取经纯化的单菌落于缺磷培养基中,150 r · min-1、30 ℃培养12 h.将菌液在8000 r · min-1条件下离心5 min,再将菌液转接于富磷培养基中,150 r · min-1、30 ℃培养至菌液变浑浊. 计算各株菌的除磷率.此后,将复筛得到的聚磷菌根据文献的方法进行16S rRNA的测序及系统发育分析.
2.2.2 理化因素对聚磷菌生长及除磷特性的影响
聚磷菌具备高效除磷能力主要基于异染颗粒对磷的贮存,菌体在生长过程中也能够利用部分磷合成细胞成分. 文献报道显示,聚磷菌在厌氧、缺磷条件下能够把贮存于异染颗粒中的磷释放出来,经厌氧释磷后将其投入富磷培养基中进行除磷实验能够大大提高除磷能力. 此外,碳源、氮源、C/N、pH、温度等都会影响聚磷菌的生长. 因此,考察不同理化因素对聚磷菌生长及除磷能力的影响是必要的,这对实现聚磷菌的工程应用有重要参考价值.
将菌株ED-12于LB培养基中培养12 h(30 ℃、150 r · min-1),按5%的接种量接种于装有30 mL缺磷培养基(PO3-4-P质量浓度为12.3 mg · L-1)的150 mL三角瓶中,30 ℃、150 r · min-1摇瓶培养12 h;再按5%的接种量将菌悬液接种于装有30 mL富磷培养基(PO3-4-P质量浓度为32 mg · L-1)的150 mL三角瓶中,30 ℃、150 r · min-1摇瓶培养. 每隔一定的时间取样测定菌株ED-12的OD600及剩余的PO3-4-P浓度,计算除磷率并绘制菌株的生长曲线图.
以聚磷菌的生长特性为基础,以乙酸钠、丁二酸钠、柠檬酸钠、葡萄糖和蔗糖为碳源,以NH4Cl、(NH4)2SO4和NH4NO3为唯一氮源,同时考察了不同C/N、起始pH和摇床转速对聚磷菌生长及除磷能力的影响.在优化过程中,已优化的参数作为后续实验的条件.此外,在最优条件下,探讨了菌株ED-12对不同起始浓度PO3-4-P的去除效果,以考察其工程应用价值. PO3-4-P的起始浓度梯度设置为:5、15、30、45、60和100 mg · L-1.
2.2.3 微生物固定化小球的制备及除氮磷初步实验
微生物固定化小球的制备按以下步骤进行:①称取4 g PVA(聚合度1750±50)溶于90 mL无菌水中,待PVA充分溶解后加入2 g SA,沸水浴加热至完全溶解,冷却至室温备用; ②分别称取2 g反硝化菌和聚磷菌湿菌体,充分稀释于10 mL无菌水中,再将稀释后的菌液加入PVA-SA体系中,充分混匀;③根据需要的小球粒径,剪去5 mL移液枪枪头尖端,吸取菌体混合物,匀速滴入5%CaCl2-饱和硼酸溶液中,交联15 min后,将小球用无菌水洗净,备用.
以不添加菌球的组别为空白对照(Blank control),以不添加微生物的固定化小球组为阳性对照(PVA+SA),按5%(m/V,g · L-1)投加小球. 24 h后取样测定水样的TN和TP浓度,计算脱氮除磷能力.
2.3 测定方法
硝态氮(NO-3)和总氮(TN)的测定采用麝香草酚分光光度法,总磷(TP)的测定采用钼锑抗分光光度法.
2.4 数据处理与统计分析
运用Microsoft Excel 2003和Origin 8.5进行数据处理、统计分析及绘图. 所有实验均进行3个重复,结果以Mean±SD表示.
3 结果与讨论
3.1 聚磷菌的分离鉴定
3.1.1 聚磷菌的分离纯化及复筛
经富集,聚磷微生物在平板上的菌落随着磷浓度的升高而减少,当磷浓度达到20 mg · L-1时,平板上已无单菌落.将磷浓度为15 mg · L-1的培养基按10-1~10-7稀释,涂布平板. 根据形态特征,将能够在培养基上生长的49个单菌落分成4类,分别为EA(12株)、EB(15株)、EC(8株)和ED(14株). 分别对EA、EB、EC和ED进行PHB颗粒染色和异染颗粒染色,初筛得到9个染色效果较明显的聚磷菌单菌落(EA、EB和ED各3个,EC无受染现象).
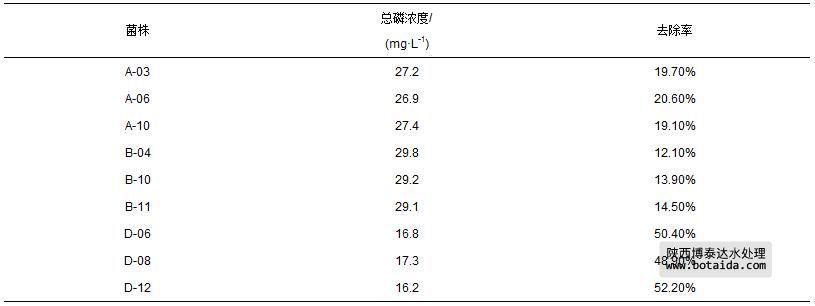
随后,对EA、EB和ED共9株聚磷菌进行复筛实验. 分别缺磷培养12 h后,转接于富磷培养基中继续培养24 h,测定除磷率,结果如表 1所示. 可知,ED-12对磷的去除能力最强,可达52.2%,因此,选择菌株ED-12作进一步研究.
表1 聚磷菌的除磷能力(起始浓度: 33.9 mg · L-1)
3.1.2 聚磷菌菌株ED-12的16S rRNA的PCR扩增及序列分析
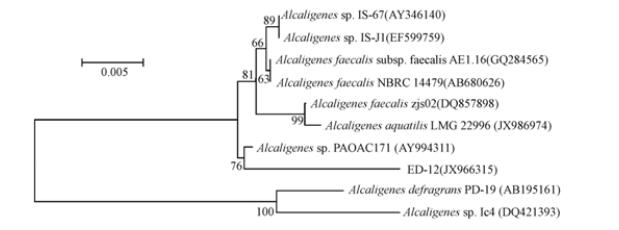
经测序,获得片段长度为1463 bp的部分16S rRNA基因序列,GenBank登录号为JX966315. 在NCBI数据库的比对结果表明,该菌株与Alicaligenes sp.的相似性达98%以上,推测其为Alicaligenes sp. 选择序列相关性较高的76个16S rRNA序列,用Cluxtal X序列分析软件分析其与ED-12的序列同源可靠性,选9个可信度较高的序列用MEGA 4.0软件通过N-J法构建系统发育树,确定ED-12的进化地位,结果如图 1所示.
图 1 基于16S rRNA 序列同源性构建的菌株ED-12和亲缘性相近的其他细菌的系统发育树
3.2 ED-12的生长曲线及除磷特性
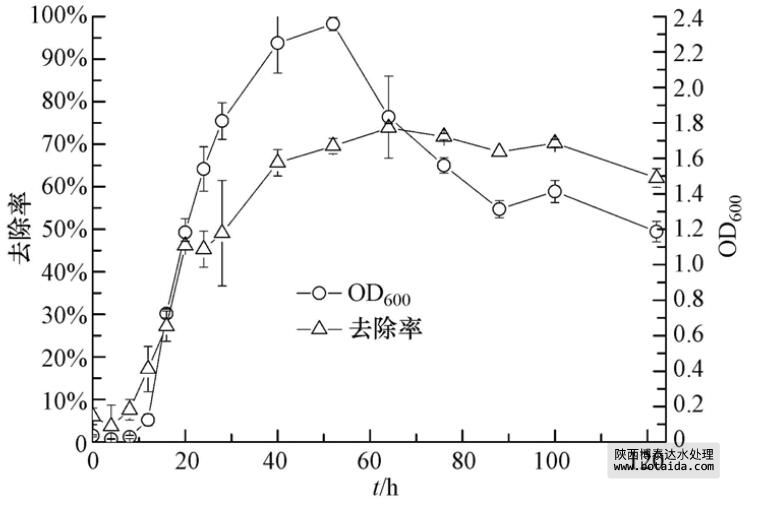
聚磷菌在缺氧、缺磷条件下会利用异染颗粒中的磷并合成PHB,将其转入有氧、富磷的培养基后会将PHB中的能量释放出来,以便更高效地聚磷,用于菌体生长并将剩余的磷储存于异染颗粒中. 图 2展示了菌株ED-12经缺磷培养后在富磷培养基中的生长情况,以及其对PO3-4-P的去除率. 结果表明,在前16 h,菌体生长处于延滞期,16 h后进入对数期,52 h后开始进入衰亡期. 在整个过程中,菌体生长特征与除磷率趋势基本吻合. 64 h内,磷浓度从30 mg · L-1左右降低到(8.12±0.32)mg · L-1,去除率达73.82%±1.02%. 此后,总磷浓度基本保持不变.
图 2 菌株ED-12的生长曲线及除磷特性
3.3 不同理化因素对菌株ED-12的生长及除磷能力的影响 3.3.1 不同碳源对菌株ED-12的生长及除磷能力的影响
有机物特征是影响生物反应器反硝化和除磷效果的重要因素,与反硝化微生物类似,大部分聚磷菌只能以低级脂肪酸类的小分子有机基质作为碳源,并将其合成的PHB以能量形式储存在细胞内.
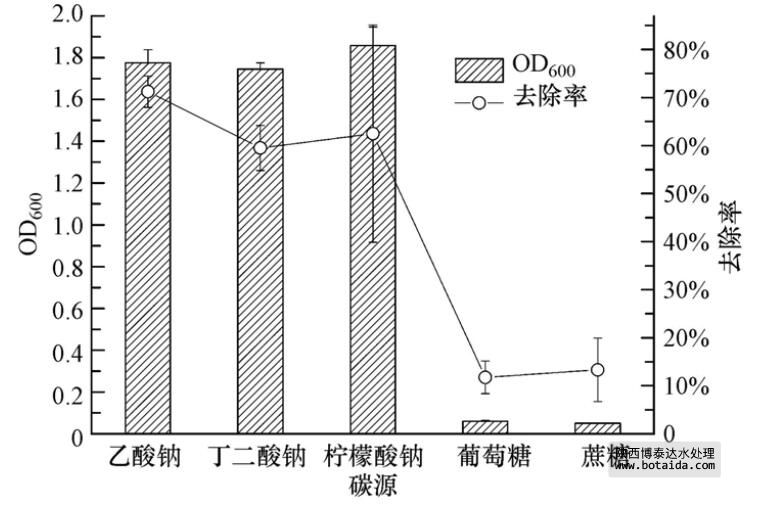
以乙酸钠、丁二酸钠、柠檬酸钠、葡萄糖和蔗糖为碳源,菌株ED-12的生长及除磷能力结果如图 3所示,菌株ED-12在以葡萄糖和蔗糖为碳源时基本不生长,对PO3-4-P的去除率低于15%. 而菌株在以乙酸钠、丁二酸钠、柠檬酸钠为碳源时长势较好,且对PO3-4-P的去除率都在50%以上. 其中,以乙酸钠为碳源时,菌株ED-12生长最旺盛,对PO3-4-P的去除率达到了70%以上. 对比5种碳源结构与分子量,相对而言,在分子结构简单、分子量低的情况下,聚磷菌的生长较好,且能达到一个较高的除磷率,这与前述观点相符. 此外,聚磷菌对不同碳源的利用效果可能还与其本身对碳源的亲和性或其他特性有关.
图 3 不同碳源对菌株ED-12生长及除磷能力的影响
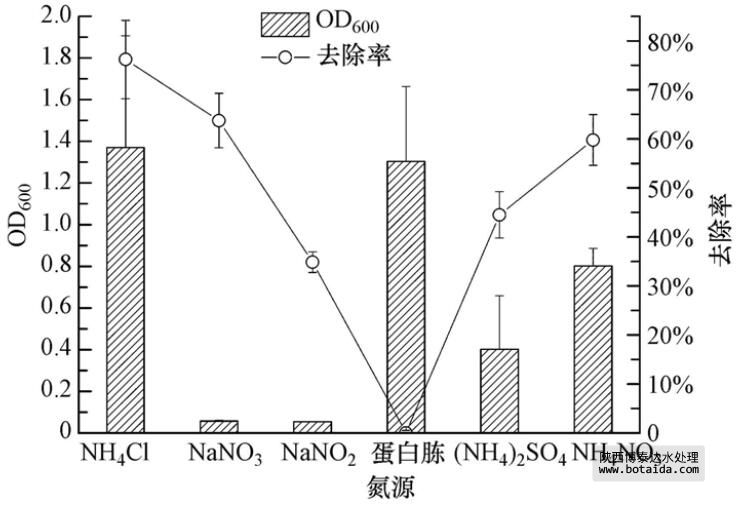
3.3.2 不同氮源对菌株ED-12的生长及除磷能力的影响
氮源是微生物细胞生长的第二大营养物质,对蛋白质、核酸和其他一些成分的合成非常重要. 多数细菌能以氨盐作为唯一氮源,由图 4可知,在以NH4Cl、(NH4)2SO4和NH4NO3为唯一氮源的培养基中,聚磷菌能够良好生长. 其中,在含有NH4Cl的培养基中OD600可在24 h内达到1.4左右. 同时,在以上3种氮源培养基中,菌株ED-12对PO3-4-P的去除率都在45%以上(NH4Cl培养基最高,可达80%). 观察发现,菌株ED-12在24 h时,在以NaNO3和NaNO2为唯一氮源的培养基中只能微弱的生长,但经48 h的培养后,开始进入对数期,并能达到较高的OD600. 此外,虽然以NaNO3和NaNO2为唯一氮源时微生物生长情况较差,但培养基中PO3-4-P浓度分别降低了63.72%±5.57%和34.84%±2.11%,说明微生物在24 h内主要通过分解PHB并将磷储存于异染颗粒中在后期用于菌体的生长. 但研究认为,NO-2的存在在有氧和无氧两种情况下都会抑制聚磷菌对磷的吸收. 图 4得出了不同的结论,其机理有待进一步研究. 在以蛋白胨为唯一氮源的培养基中,菌株ED-12长势较好,但蛋白胨含有含磷杂质,因而影响了PO3-4-P去除率的计算.
图 4 不同氮源对菌株ED-12生长及除磷能力的影响
由此可知,聚磷菌ED-12菌株能够在以NH4Cl、NaNO3、NaNO2、(NH4)2SO4、蛋白胨和NH4NO3为唯一氮源的培养基中生长.根据微生物生长量、生长周期及对PO3-4-P的去除率,NH4Cl是菌株ED-12生长及发挥除磷能力的最佳氮源.
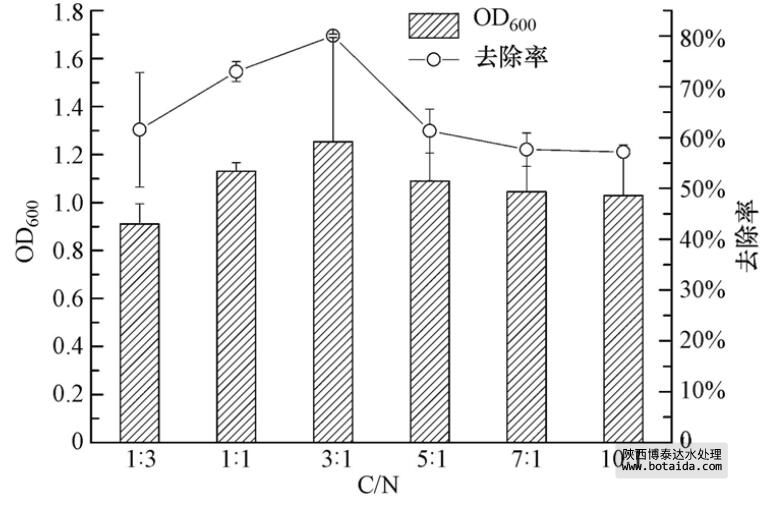
3.3.3 不同C/N对菌株ED-12的生长及除磷能力的影响
碳源和氮源是微生物生长的重要物质,不同微生物对碳源和氮源的需求量不同. 细菌对氮源的需求量大,真菌和放线菌等对碳源的需求量大. 在脱氮除磷工艺中,必须考虑C/N以实现微生物对废水中氮、磷的有效利用.
考察C/N对聚磷菌ED-12菌株生长及除磷能力的影响,结果(图 5)表明,随着C/N的升高,菌体生物量增大,同时对PO3-4-P的去除率也随之提高,C/N为3 ∶ 1时达到最大值. 此后,微生物的生长及对PO3-4-P的去除率又随着C/N的升高而缓慢降低,说明过高的C/N导致氮源不足,微生物生长也因此受到了抑制.
图 5 不同C/N对菌株ED-12生长及除磷能力的影响
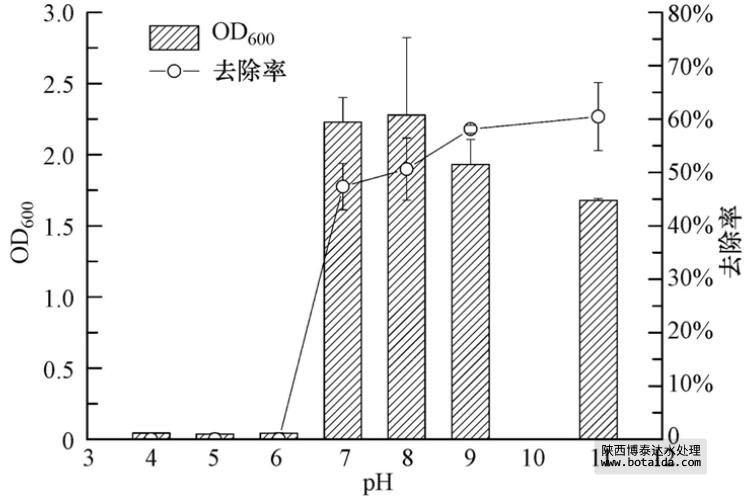
3.3.4 不同pH对菌株ED-12的生长及除磷能力的影响
在好氧条件下,聚磷菌能分别以醋酸和PO3-4为碳源和磷源,生成聚合态磷作为储能物质,储存于细胞内并伴随着产生OH-,导致发酵液的pH值逐渐升高. 其聚磷过程可用式(1)表示.
图 6 不同起始pH对菌株ED-12生长及除磷能力的影响
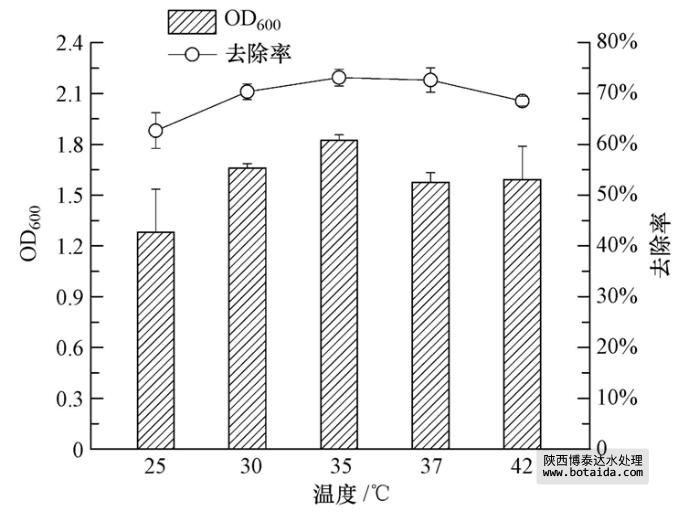
3.3.5 不同温度对菌株ED-12的生长及除磷能力的影响
温度是除有机物特征外影响微生物生长的另一重要因素,但王亚宜等(2006)和姜体胜等(2007)认为,温度不会影响聚磷菌发挥聚磷作用.
由图 7可知,随着温度的升高,聚磷菌ED-12菌株的生物量也增大,35 ℃时最适宜ED-12菌株的生长. 相应地,ED-12菌株对PO3-4-P的去除率也呈先增后减的趋势,在35 ℃时达到最大值(73.14%±1.65%). 由此可知,不同温度对聚磷菌ED-12菌株除磷效果的影响比对其生长的影响大得多.温度对聚磷效果存在影响,这与Panswad等(2003)的研究结果相符,即35 ℃最有利于聚磷菌发挥聚磷作用,过高或过低的温度都会抑制其效果,说明不同的微生物聚磷特性存在差异.
图 7 不同温度对菌株ED-12生长及除磷能力的影响
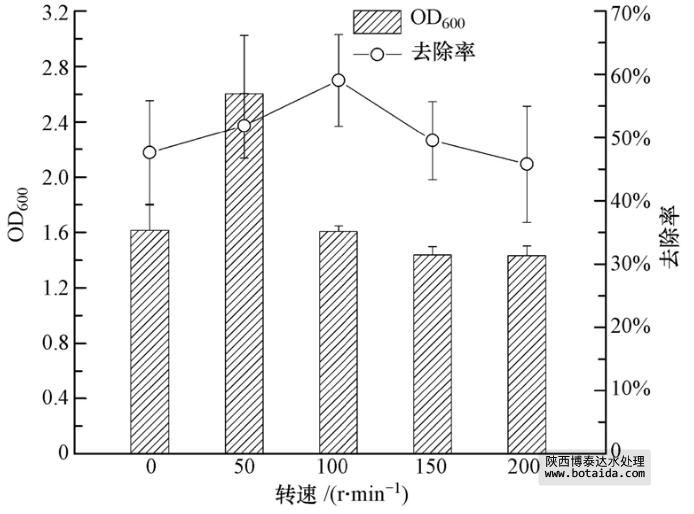
3.3.6 不同摇床转速对菌株ED-12的生长及除磷能力的影响
研究表明,溶氧是影响生物除磷效果的一个重要因素. 为了满足聚磷菌生物膜内对氧的需求量,加快氧的传递速率,增加活性生物膜的厚度,加快聚磷菌的好氧吸磷速率,必须提高液相主体中溶解氧的含量. 此外,低溶氧有利于反硝化除磷,高溶氧有利于好氧吸磷(在含硝酸盐或亚硝酸盐培养中可以进行厌氧生长).
如图 8所示,摇床转速在0~200 r · min-1之间,菌株ED-12都能生长. 当摇床转速为50 r · min-1时,菌体OD600最高,达2.60±0.62;当摇床转速为100 r · min-1时,对PO3-4-P的去除率最高,达59.05%±7.26%. 在各培养条件下,菌体的生长与除磷率趋势不尽相同,说明二者是彼此独立的过程.静置培养时,储存于异染颗粒的磷被分解,用于菌体的生长,此时对PO3-4-P的去除率近50%,说明菌株ED-12在厌氧条件下还能将环境中的磷用于生长. 好氧条件下,菌体将部分磷用于生长,并将剩余的磷储存于异染颗粒中,因此,在转速≥50 r · min-1时也能维持一个较高的除磷率. 观察发现,摇床转速过高未必能提高除磷率.
图 8 不同摇床转速对菌株ED-12生长及除磷能力的影响
微生物固定化小球脱氮除磷实验表明(详见3.5节),ED-12菌株在低溶氧与高溶氧时都存在除磷或聚磷作用,二者作用能力的强弱导致了图 8所示的结果,即高溶氧时对PO3-4-P的去除率与低溶氧时相近. 当摇床转速为100 r · min-1时,培养基中的溶氧最适合ED-12菌株对磷的反硝化去除或储存于异染颗粒中.低溶氧和高溶氧条件下,则分别表现为对磷的生长利用和积聚. 因此,对废水中的磷的有效去除可以通过调节溶氧而实现,此过程包括生长利用和聚磷作用.
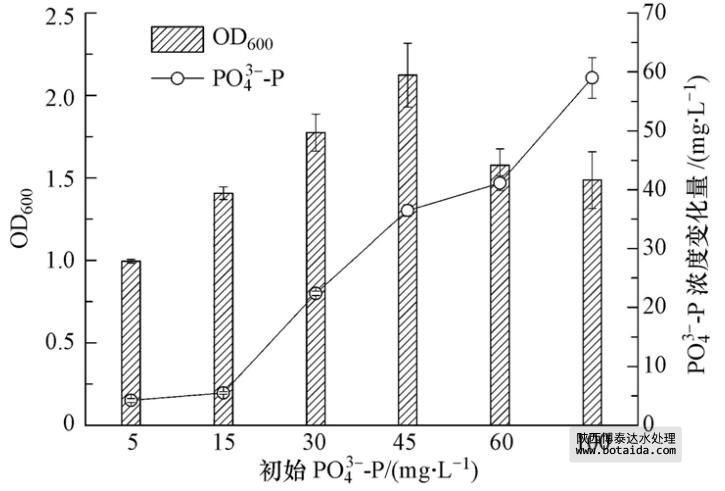
3.4 菌株ED-12对不同起始浓度PO3-4-P的去除效果
聚磷菌对磷的去除包括两条途径:生长利用和异染颗粒贮磷.根据聚磷菌分离筛选原理,过高浓度的PO3-4-P会抑制聚磷菌的生长与繁殖. 因此,考察不同起始浓度的PO3-4-P对聚磷菌生长的影响及相应条件下聚磷菌对PO3-4-P的去除效果,对分析聚磷菌生长与聚磷过程的关系及指导聚磷菌在富营养化水体中的工程应用有实际意义.
如图 9所示,随着PO3-4-P浓度的升高,菌株ED-12的OD600呈先增后减的趋势. 当PO3-4-P浓度为45 mg · L-1时,菌株ED-12的长势最好,过高的PO3-4-P反而会抑制菌体的生长.这是由于微生物生长受到了基质自抑制作用,这与聚磷菌分离筛选的结论相符. 观察发现,除5 mg · L-1组,随着PO3-4-P浓度的升高,菌株ED-12对PO3-4-P的去除率与聚磷菌生物量成正相关(图中未显示),但PO3-4-P的变化浓度始终呈一递增趋势. 当PO3-4-P浓度>45 mg · L-1时,培养基中出现了部分沉淀物. 正如3.3.4节的结论,聚磷过程会释放OH-,微生物生长越快,在相同的时间内产生的OH-也越多,因此,就有越多的PO3-4-P形成了沉淀,这合理地解释了以上的现象.以上结论说明,Alcaligenes sp. ED-12对磷的吸收是一个复杂的过程,在菌体生长及聚磷过程中,不仅会受理化因素尤其是pH的影响,溶液中的磷浓度也是影响聚磷菌生长与聚磷效果的一个关键因素. 由以上分析可知,菌株ED-12对PO3-4-P的去除能力很强,在不同PO3-4-P起始浓度梯度条件下,最高去除率可达81.02%±2.27%,此时的PO3-4-P浓度变化量为(36.46±1.02)mg · L-1.
图 9 菌株ED-12对不同起始浓度PO3-4-P的去除效果
表 2所示为典型的聚磷菌对不同起始浓度PO3-4-P的去除效果. 由表可知,除耳葡萄球菌(Staphyloccocus auricularis)、Accumulibacter和Competibacter外,其他菌株对浓度<50 mg · L-1的PO3-4-P去除效果一般. 在当前所报道的产碱杆菌除磷能力实验中,都未开展磷浓度梯度实验;除Bao等(2007)的报道外,其余产碱杆菌菌株对浓度<30 mg · L-1的PO3-4-P去除效果都低于90%. 本研究所得菌株不仅在磷浓度为45 mg · L-1时具有较高的去除率,当浓度高达60 mg · L-1甚至100 mg · L-1时还能维持较高的活性及去除率. 因此,菌株ED-12是一株较理想的聚磷菌,具有广阔的应用前景. 然而,微生物聚磷过程比较复杂,今后的研究工作可围绕精确定量菌株Alcaligenes sp. ED-12的磷吸收在生长利用及贮存方面的比例及吸收与释放的关系上.
表2 不同微生物对磷的去除效率
微生物PO3-4-P起始浓度/
(mg·L-1)PO3-4-P去除率参考文献
金黄色葡萄球菌(Staphyloccocus aureus)1065%南亚萍等,2013
耳葡萄球菌(Staphyloccocus auricularis)50>90%Choi et al., 2000
肠杆菌(Enterobacter sp.)10.2594.6%张培玉等,2011
Accumulibacter & Competibacter53.3>80%Oehmen et al., 2005
克雷伯氏菌(Klebsiella terrigena)27<80%赵海泉等,2009
约氏不动杆菌(Acinetobacter johnsonii)1065.24%连丽丽,2009
产碱杆菌(Alcaligenes sp.)7.590%刘亚男等,2005
产碱杆菌(Alcaligenes sp.)10>90%Bao et al., 2007
产碱杆菌(Alcaligenes sp.)20.2582.3%孙梦,2011
产碱杆菌(Alcaligenes sp.)28.7377.1%焦中志等,2009
产碱杆菌(Alcaligenes sp.)4581%本研究
3.5 固定化聚磷微生物小球除氮磷实验
微生物的固定化是实现微生物活性持留的途径之一,同时,固定化也有助于目标微生物的投加与回收. 当前应用最广泛的固定化材料是聚乙烯醇和海藻酸盐,固定化交联剂通常选择2%~5%的CaCl2-饱和硼酸溶液.
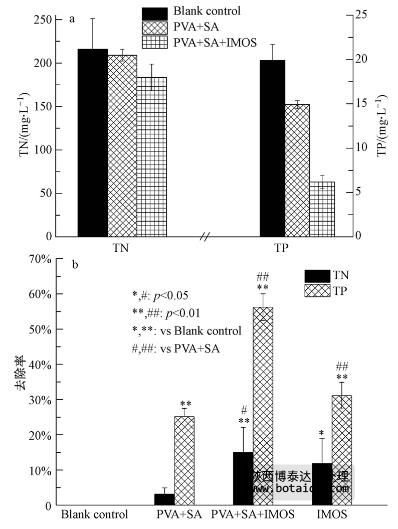
根据赖子尼等(2008)的实验配方制备的固定化聚磷微生物小球的弹性与机械强度较好,对含氮磷废水的净化效果表明,菌球对磷有较强的去除能力(从(19.91±1.81)mg · L-1 降至(6.19±0.76)mg · L-1),同时能够去除一定的氮(从(215.82±35.29)mg · L-1 降至(183.42±15.35)mg · L-1)(图 10 a). 二者的去除率分别达56.21%和15.01%(图 10 b). 其中,固定化材料对氮的吸附比例较小,而对磷的吸附较显著(p<0.01),这可能与固定化材料的表面官能团及CaCl2等对PO3-4的亲和力强于NO-3有关. 同时,固定化微生物(IMOs)对磷的去除效果也优于氮,说明菌株ED-12可能不具备反硝化能力,对氮的利用仅是生长所需. 由PVA+SA+IMOs组与PVA+SA组比较可知(图 10b,#表示),无论是氮还是磷,都存在显著差异,说明固定化微生物是氮磷去除的主要贡献者.
图 10 固定化聚磷微生物小球对氮磷的去除效果
4 结论
1)本研究成功从高岐村某排污口筛选出1株典型的聚磷微生物,鉴定发现其属于产碱杆菌属(Alcaligenes sp.)细菌,将其命名为Alcaligenes sp. ZGED-12.
2)研究发现,菌株ED-12能在高磷浓度下生长,16 h时进入生长对数期. 理化因素实验确定了聚磷菌ED-12的最适生长及发挥除磷能力的条件,其中,碳源、氮源和pH对其影响最大.磷浓度实验表明,低浓度磷不利于菌株ED-12的生长,但过高浓度反而会抑制菌体生长及发挥聚磷功能,最优磷浓度为45 mg · L-1.
3)本研究成功实现了聚磷微生物的固定化,该固定化小球对氮磷的去除显示出了良好的效果,作用机理包括固定化材料对氮磷的物理化学吸附及微生物的吸收利用(或贮存). 其中,微生物在这个过程中起着关键作用.
如需要产品及技术服务,请拨打服务热线:13659219533
选择陕西博泰达水处理科技有限公司,你永远值得信赖的产品!
了解更多,请点击www.botaida.com