氯代烃性质活泼、种类繁多,是经常使用的化工原料、中间体和有机溶剂,被广泛应用于飞机发动机、汽车部件、电子元件以及衣服脱脂等领域。但随着我国经济社会发展和产业结构的优化,污染企业陆续搬出城市中心区,由于管理不善和历史遗留问题,绝大多数搬迁企业都存在氯代烃泄露以及不正当排放引起的地下水污染问题。氯代烃不易降解并具有致癌、致畸、致突变效应。因此,地下水的氯代烃污染治理已刻不容缓。
化学氧化法是利用化学氧化药剂去除污染物的处理方法。这种方法依靠氧化剂的强氧化性破坏氯代烃等有机物的化学键,使其转化成氯离子、二氧化碳和水等无害物质,该方法已被证明能有效降解地下水中的有机污染物,且对环境的破坏性小,所使用的化学氧化剂主要有高锰酸钾、臭氧、过氧化氢和过硫酸钠。过硫酸盐是一种强氧化剂,其分解产生的硫酸根自由基有很强的氧化性,相比于高锰酸盐,过硫酸盐能降解更多种类的难降解有机污染物,因此过硫酸盐作为一种新型的化学氧化剂得到日益广泛的应用。
的应用。过硫酸盐一般是指过硫酸钾、过硫酸钠和过硫酸氨3种。过硫酸钾的溶解度比其它2种过硫酸盐低,过硫酸氨存在氨根,因此,在实际的化学氧化中所用的过硫酸盐一般是过硫酸钠。过硫酸钠在25℃的环境下非常稳定,要使其与污染物快速充分地反应,需要将它激活产生自由基,已知常用的激活方法有热激活、碱激活、过渡金属激活等。热激活有能耗高的天然劣势,亚铁离子本身能与过硫酸盐快速反应,因而有作用范围小、原料消耗量大、易产生大量铁泥等问题,相比而言,碱激活应用更广泛。
用二价铁催化过氧化氢分解去除污染的反应称为传统的芬顿反应。H2O2被催化产生的羟基自由基HO?在污染物去除方面没有选择性,可以迅速的修复大多数氯代烃污染物。传统的芬顿反应的缺点是需要在特定的pH值范围(pH=2~4)内才能进行。反应过程中pH值过高,可能会生成含铁的羟基氧化物,降低去除效率。同时过氧化氢在修复中常常发生非目标分解,为了使过氧化氢更稳定,使其在地下的传输距离更远,有部分研究者使用稳定剂延长过氧化氢的寿命。如Watts等用柠檬酸盐、丙二酸盐和肌醇六磷酸盐分别作为过氧化氢的稳定剂,去除土壤中的有机污染物,结果发现稳定过的过氧化氢的分解减慢了50%。目前经验证比较有效的过氧化氢稳定剂有:柠檬酸盐、磷酸盐、EDTA、丙二酸盐等,另外值得注意的是磷酸盐可以稳定亚铁离子,降低亚铁离子在水中的氧化速度。
子在水中的氧化速度。目前国内对氯代烃的修复技术已有不少研究,但多采用实验室配制一定浓度的氯代烃母液作为研究对象,针对来自实际污染场地现场的地下水研究较少。笔者通过采集广西某氯代烃污染场地的地下水作为研究对象,开展氢氧化钠激活过硫酸钠和焦磷酸钠作稳定剂的改性芬顿两种氧化体系降解其中氯代烃的研究,考察氧化剂浓度及反应时间等对氯代烃降解效果的影响作用,旨在为氯代烃污染地下水修复技术的现场应用提供实践研究依据。
一、实验部分
1.1 实验材料
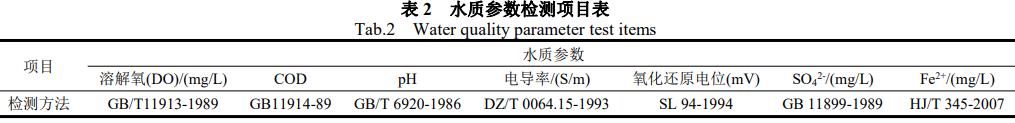
过硫酸钠(分析纯、国药集团化学试剂有限公司)、氢氧化钠(分析纯、国药集团化学试剂有限公司)、七水硫酸亚铁(分析纯、国药集团化学试剂有限公司)、过氧化氢(分析纯、国药集团化学试剂有限公司)、焦磷酸钠(分析纯、国药集团化学试剂有限公司)。SHZ-B水浴振荡器(上海博迅实业有限公司);AL204电子天平、7890A气相色谱(Agilent,USA)。
1.2 实验方法
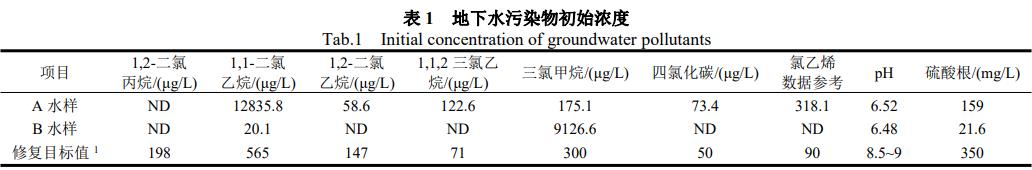
(1)本实验设置两个水样,分别为A井和B井采集的地下水样(简称A、B水样)。初始有机物污染物浓度(表1)及样品水质参数列于表1,初始有机物污染物检测方法参考HJ686-2014,水质参数检测项目及检测方法见表2。修复目标值参照地下水Ⅳ类标准:
(2)取200mL水样于三角瓶中,对于碱激活过硫酸钠氧化体系,先向水样中投加过硫酸钠,搅拌混合后再滴加氢氧化钠,A和B两井水样中氢氧化钠浓度固定为0.05%,投加不同质量的过硫酸钠获得过硫酸钠含量分别为0.04%、0.10%、0.50%、1.00%、1.50%、2.00%的A井水样和过硫酸钠含量分别为0.10%、0.50%、1.00%、1.50%、2.00%、3.00%的B井水样,另外,分别向A井水样和B井水样中分别只单独加入1.00%和2.00%的过硫酸钠,而不加氢氧化钠,以验证在无激活剂存在下,过硫酸钠在水中是否会产生具有氧化作用的硫酸根自由基。对于改性芬顿氧化体系,依次投加焦磷酸钠、硫酸亚铁,搅拌混合后,再滴加过氧化氢,边加边搅拌,A井水样中七水硫酸亚铁和焦磷酸钠分别固定为1.11%和2.13%,投加不同质量的过氧化氢获得过氧化氢含量分别为1.50%、2.00%、3.00%的A井水样,B井水样中七水硫酸亚铁和焦磷酸钠分别固定为1.67%和3.19%,投加不同质量的过氧化氢获得过氧化氢含量分别为2.25%、3.00%、4.50%的B井水样。
(3)投加药剂后的三角瓶封口覆膜,恒温振荡养护。反应后1h、2h、3h、4h、5h取样测定水中污染物浓度、氧化剂残留量及水质参数。
二、结果与讨论
2.1 氧化药剂投加量对氯代烃降解的影响
氧化药剂浓度是反应过程中重要影响因素之一,且氧化药剂在进行实际场地修复时药剂的用量是主要的经济因素,一次需尽可能准确地确定氧化药剂的用量。
对于A水样初始检测到的1,2-二氯乙烷、1,1,2三氯乙烷、四氯化碳三种氯代烃在投加药剂后均检测不到,对于B水样初始检测到的1,1-二氯乙烷在投加药剂后检测不到,可能是由于这几种氯代烃在水样中的初始浓度较低,较容易被降,因此不再讨论药剂添加量对以上几种氯代烃的降解的影响,尽管A水样中三氯甲烷的初始浓度低于修复目标值,在本次实验中也考察了氧化药剂对其降解的影响。经过实验发现,对于A水样处理后比较难难降解的有机物为主要1,1-二氯乙烷和三氯甲烷,而对于B水样处理后比较难难降解的有机物为主要三氯甲烷和新生成的四氯化碳,因此对于A、B两水样,主要关注加入氧化剂后1,1-二氯乙烷、三氯甲烷和新生成的四氯化碳是否能够达到修复目标。
以A、B两水样为研究对象,碱激活过硫酸钠体系固定氢氧化钠投加量为0.05%,改性芬顿体系固定七水硫酸亚铁和焦磷酸钠为1.11%和2.13%的条件下,分别研究过硫酸钠和过氧化氢投加量对A水样中1,1-二氯乙烷、B水样中三氯甲烷和新生成的四氯化碳降解的影响。
2.1.1 氧化药剂投加量对A水样中氯代烃降解的影响
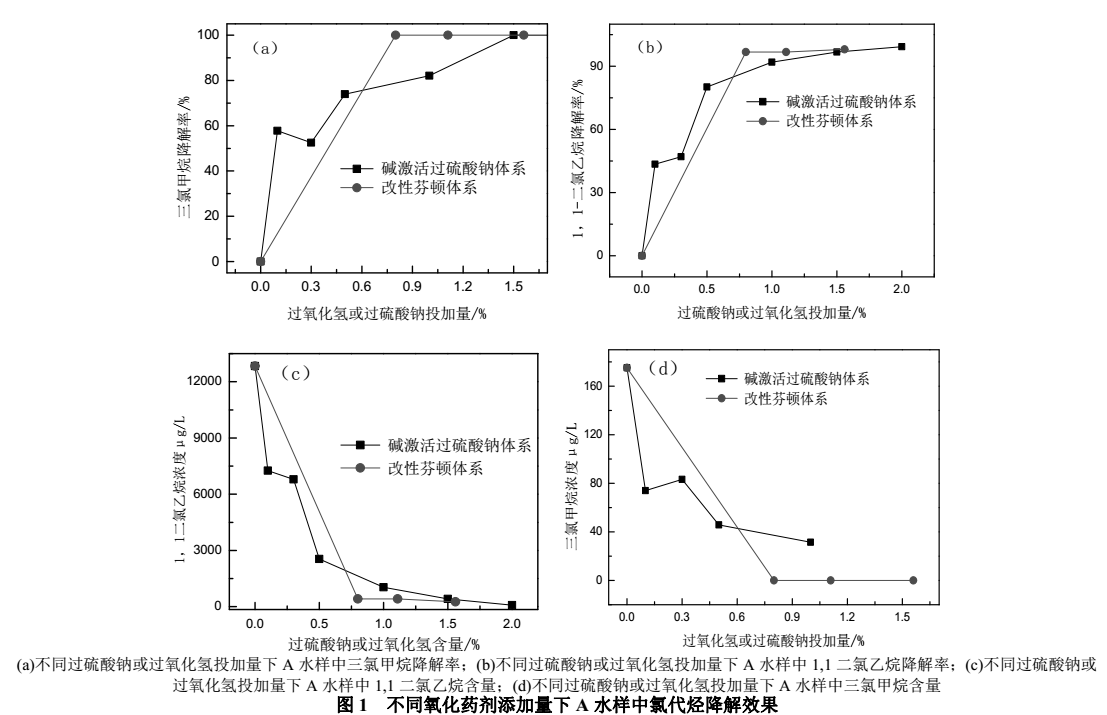
由图1可以看出,对于碱激活过硫酸钠体系,随着过硫酸钠投加量的增加,1,1-二氯乙烷的降解率不断提高,过硫酸钠投加量在0%~1.0%时1,1-二氯乙烷和三氯甲烷降解率提升较快,随后逐渐变慢,当过硫酸钠投加量到达1.5%时1,1-二氯乙烷降解率已达到修复目标,三氯甲烷已完全降解。1,1-二氯乙烷的降解速率随着过硫酸钠投加量增加而降低,当过硫酸钠投加量超过1.5%时,继续添加药剂对降解率和降解速率的提升效果不大,原因是高浓度的过硫酸钠活化产生更多的硫酸根自由基,当过硫酸钠达到一定浓度后1,1-二氯乙烷分子与硫酸根自由基的接触概率不再增加,对反应的促进作用有限,出于经济性的考虑,过硫酸钠投加量为1.5%比较合理。另外,值得注意的是,单独加入1.00%过硫酸钠而不加氢氧化钠时,A水样中1,1-二氯乙烷和三氯甲烷的降解率分别为91.92%和72.13%,与加入1.5%过硫酸钠+0.05%氢氧化钠处理下1,1-二氯乙烷和三氯甲烷的降解率相差不大,有研究表明,过硫酸钠在pH<3的酸性条件下主要以SO4-·存在,其标准氧化还原电位E0=+2.60V,远高于S2O82-(E0=+2.01V),接近于羟基自由基(E0=+2.70V),这说明在不使用激活剂的情况下,一部分S2O82-可活化分解为SO4-·从而对有机污染物具有一定的降解能力。
而对于改性芬顿体系,在过氧化氢投加量最低(0.8%)时,1,1-二氯乙烷的含量迅速降低,降解率达到95.60%,达到修复目标,随着过氧化氢投加量增加,其降解率仅有小幅上升。Watts等提出过氧化氢的浓度必需大于2%(0.6mol/L或20.4g/L)去除氯代烃才有效,但是经过优化实验发现过氧化氢浓度为1%(0.3mol/L)时足以达到去除大部分氯代烃的目的。出于经济性考虑,在实际工程应用中,采用0.28%硫酸亚铁+0.53%焦磷酸钠+0.80%过氧化氢的配比降解A水样的挥发性有机污染物较为合理。
2.1.2 氧化药剂投加量对B水样中氯代烃降解的影响
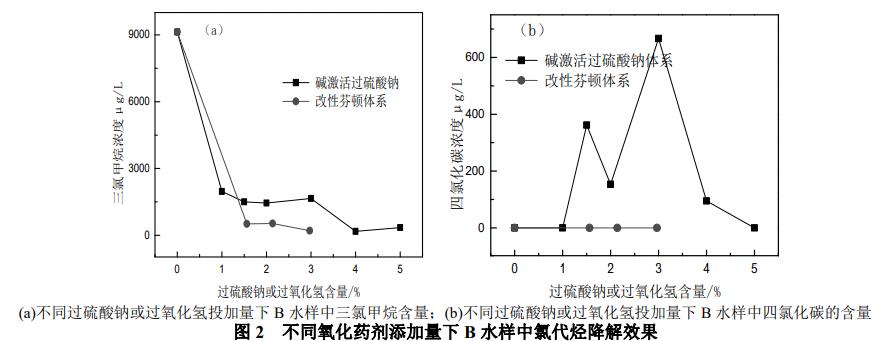
由图2(a)、(b)可以看出,对于碱激活过硫酸钠体系,随着过硫酸钠投加量的增加,水样中三氯甲烷浓度不断降低,过硫酸钠投加量在0%~1.0%时三氯甲烷浓度降低较快,随后逐渐变慢,当过硫酸钠投加量到达4.0%时三氯甲烷浓度已低于修复目标值(降解率为98.06%)。初始检测B水样中含有四氯化碳,当过硫酸钠投加量在1.0%~4.0%时,水样中检测到高于修复目标值的四氯化碳,特别是当过硫酸钠投加量为3.0%时,水样中四氯化碳的含量为修复目标值的10倍,当过硫酸钠投加量提高至5.0%,水样中检测不到四氯化碳。而对于A水样初始检测到的四氯化碳,在最低过硫酸钠投加量为0.10%时已经检测不到,后续继续增加过硫酸钠投加量也未出现,分析原因主要是与A、B两水样中的氯代烃种类不同有关,A水样中主要难降解的污染物1,1-二氯乙烷与四氯化碳相差一个碳原子,而B水样中主要难降解的污染物三氯甲烷与四氯化碳结构只差一个氯原子,在氧化过程中容易结合氯原子形成四氯化碳。
另外,值得注意的是,单独加入2.00%过硫酸钠而不加氢氧化钠时,B水样中三氯甲烷的降解率为72.25%,低于2.00%过硫酸钠+0.05%氢氧化钠处理下三氯甲烷的降解率(84.41%),分析原因可能是在碱性条件下SO4-和OH-反应生成了氧化能力较强的·OH,促进了三氯甲烷的降解。
而对于改性芬顿体系,在过氧化氢投加量最低(1.56%)时,三氯甲烷的含量由9126.6μg/L迅速降低515.3μg/L,随着过氧化氢投加量增加至2.14%,三氯甲烷的含量变化不明显,高于修复目标值,当过氧化氢投加量增加至2.97%时三氯甲烷的含量低于修复目标值(降解率为97.73%)。三种过氧化氢投加量下,均未检测到四氯化碳,分析原因可能是过氧化氢在亚铁离子或含铁矿物的催化下产生活泼的羟基自由基(Eθ(H2O2)=1.77V,Eθ(HO·)=2.76V),有研究表明,羟基自由基能与大多数有机污染物发生非选择性反应,羟基自由基与链烷烃的反应速率比较高,尤其是氯代和氟代烷烃,如CCl4、CHCl3、六氯乙烷和氟氯昂与羟基自由基反应活泼(kOH≈106L·mol-1·s-1)。
2.2 反应时间对氯代烃降解的影响
以A水样中比较难降解的1,1-二氯乙烷为研究对象,固定氢氧化钠投加量为0.05%,研究过硫酸钠投加量为0.1%、0.5%、2%的条件下,反应时间1~5h内1,1-二氯乙烷的降解程度。
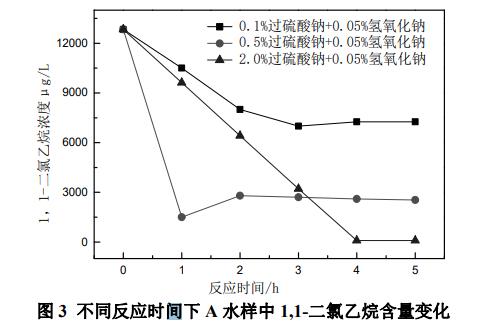
由图3可以看出,当过硫酸钠投加量为0.1%时,1,1-二氯乙烷含量在反应时间为2h之前呈急剧下降趋势,2h之后变化缓慢,说明0.1%过硫酸钠+0.05%氢氧化钠处理在2h内剧烈反应,2h之后有可能已达到反应最大限度。当过硫酸钠投加量为0.5%时,1,1-二氯乙烷含量在反应时间为1h之前呈急剧下降趋势,1h之后有小幅上升,但变化缓慢,说明0.5%过硫酸钠+0.05%氢氧化钠处理在1h时可能已经达到反应的最大限度。当过硫酸钠投加量为2.0%时,1,1-二氯乙烷含量在反应时间为4h之前呈急剧下降趋势,4h之后无明显变化,说明2.0%过硫酸+0.05%氢氧化钠处理在4h时可能已达到反应最大限度。
2.3 降解过程中pH和硫酸根的变化
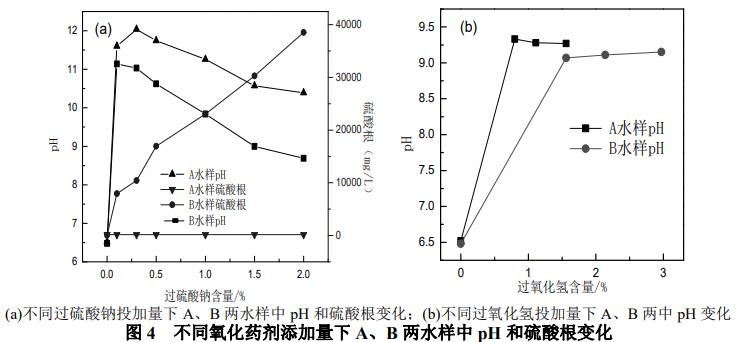
由图4(a)可以看出,对于A水样来说,加入不同含量的过硫酸钠后氧化体系的pH均大于10,而硫酸根浓度没有变化。pH是影响过硫酸盐活化的一个重要因素,根据碱活化过硫酸钠的反应机理,在碱过量的情况下,S2O82-分解形成的SO4-·会与OH-反应生成·OH,因此pH>10的碱性条件下氧化体系中主要以·OH存在,而当1.5%过硫酸钠+0.05%氢氧化钠处理下,A水样中主要难降解的有机物1,1-二氯乙烷已达到修复目标,这说明pH>10的碱性条件下以·OH为主的氧化体系有利于1,1-二氯乙烷的降解。需要指出的是,尽管随着过硫酸钠添加量的增加,可以促进水样中氯代烃降解,且当1.5%过硫酸钠+0.05%氢氧化钠处理下,A水样中的主要难降解的有机物1,1-二氯乙烷已达到修复目标,但pH超出了地下水Ⅳ类标准。
而对于B水样来说,随着过硫酸钠添加量的增加氧化体系的pH先上升后下降,硫酸根浓度也逐步上升,4.0%过硫酸钠+0.05%氢氧化钠处理下,三氯甲烷降解率为98.06%,已达到修复目标,同时pH达到地下水Ⅳ类标准,有研究指出pH=8~10时,则SO4-·和·OH共同存在,说明pH=8~10时,SO4-·和·OH共同存在的氧化体系有利于三氯甲烷的降解。B水样中加入氧化剂处理后硫酸根均超出地下水Ⅳ类标准,但有研究表明,硫酸盐在地下,尤其是饱和层内,可以通过地下水流动的稀释作用和被氧化后恢复的微生物还原环境而逐渐去除。场地数据显示硫酸盐积累只是暂时性问题,通常半年后,硫酸盐浓度即可恢复至修复前的基准值。
由图4(b)可以看出,对于A、B两水样,随着过氧化氢的用量增加,氧化体系pH变化不明显,A水样中pH与不加药剂相比高出30%,B水样中pH与不加药剂相比高出28.9%,略超过地下水Ⅳ类标准。对于芬顿试剂,在碱性条件下,二价铁离子形成Fe(OH)2和Fe(OH)3沉淀,对于原位化学氧化有可能导致堵塞孔隙,影响芬顿试剂的修复半径。对于芬顿反应在近中性条件下的氧化能力是科研工作者近年来比较感兴趣的课题之一,但在实际应用中不建议人为加入硫酸、硝酸等酸性试剂降低含水层的pH值,因为天然的地下土壤和含水层一般具有强大的酸碱缓冲能力。如果人为加入硫酸、硝酸等酸性试剂降低含水层的pH值,不仅会增加处理成本,还会对处理区域的微生物和植物生长带来危害。
2.4 调节pH实验
通过前述实验发现,尽管添加1.5%过硫酸钠+0.05%氢氧化钠后可以使A水样中主要难降解的有机物为1,1-二氯乙烷达到修复目标pH超出了地下水Ⅳ类标准,因此以A水样为处理对象,1.5%过硫酸钠投加量下,添加不同配比的氢氧化钠用量,完全反应后(5天)测定pH的变化情况。
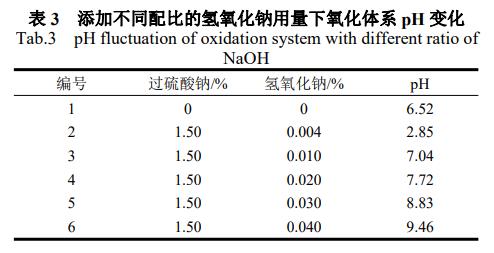
结果表明:1.5%过硫酸钠+0.03%氢氧化钠处理下,反应完全后,水中pH为8.83,达到地下水Ⅳ类标准,1,1-二氯乙烷含量为456μg/L,低于添加1.5%过硫酸钠+0.05%氢氧化钠时的降解率,但也满足修复目标的要求。
三、结论
(1)两种氧化体系对于A水样中主要污染物1,1-二氯乙烷和三氯甲烷均有较好的降解效果,相比较而言,对于较低浓度的三氯甲烷的降解,改性芬顿体系比碱激活过硫酸钠体系效果更明显,对于碱激活过硫酸钠体系固定氢氧化钠投加量为0.05%的条件下,过硫酸钠添加量达到1.5%以上时1,1-二氯乙烷和三氯甲烷可达到修复目标,但pH超出了地下水Ⅳ类标准,后续调整使用配比为1.5%过硫酸钠+0.03%氢氧化钠后,降解率达到修复目标要求的同时pH也能满足地下水Ⅳ类标准。对于改性芬顿体系在七水硫酸亚铁和焦磷酸钠使用量为1.11%和2.13%的条件下,过氧化氢添加量超过0.8%时1,1-二氯乙烷和三氯甲烷可达到修复目标,pH略超地下水Ⅳ类标准。
(2)两种氧化体系对于B水样中三氯甲烷均有较好的降解效果,碱激活过硫酸钠体系在降解过程中有新物质四氯化碳生成,需要添加过硫酸钠添加量超过5%才能使得四氯化碳降解,相比较而言,改性芬顿体系自始至终没有四氯化碳生成。而A水样中初始检测到的四氯化碳在添加碱激活过硫酸钠和改性芬顿两种药剂后均检测不到,初步分析主要与A、B两水样中氯代烃的种类不同有关。
(3)过氧化氢和过硫酸钠氧化氯代烃时都受到pH的影响,同时不同种类氯代烃在不同氧化体系中降解所需的最佳pH也不同。对于碱激活过硫酸钠体系,pH>10时以·OH为主的氧化体系有利于1,1-二氯乙烷的降解,pH=8~10时,SO4-·和·OH共同存在的氧化体系有利于三氯甲烷的降解。( >
如需要产品及技术服务,请拨打服务热线:13659219533
选择陕西博泰达水处理科技有限公司,你永远值得信赖的产品!
了解更多,请点击www.botaida.com